| 合规解读 |
欧盟SDS最新更新要求深度解读
来源:合规化学 点击数:10943
2020年6月26日,欧盟官方公报(Official Journal of European Union L 203/28)发布了对REACH法规附件II的修订文件(COMMISSION REGULATION (EU) 2020/878)。REACH法规附件II规定了欧盟版SDS内容和格式的详细要求,类似我国的GB/T16483和GB/T17519。
新版文件将从2021年1月开始执行,旧版的SDS可以沿用到2022年12月31日,主要考虑到工业界更新SDS需要时间周期。
本期合规解读,小编讲给大家重点梳理一下新文件有哪些新的合规要求。
一、新版文件出台的背景
1,纳米材料管理要求生效
2020年1月1日起,欧盟2018/1881法规,针对REACH法规附件I、III以及VI到XII的修订将正式生效。根据(EU)2018/1881的规定,有关纳米材料的相关信息必须在SDS中得到体现。
2,紧跟联合国GHS制度的修订步伐
联合国GHS制度自2003年出台以来,保持每两年一修订的更新频率。欧盟REACH法规附件II作为欧盟SDS编写的技术要求,理应要紧跟GHS制度的修订步伐。本次修订吸纳了联合国GHS制度第6和第7修订版有关SDS编写的新要求。
友情提醒:2019年联合国发布了第8修订版GHS制度,因此欧盟有关SDS的要求还是落后GHS制度一个版本。
3,欧盟配方唯一性标识(UFI)要求生效
2017年3月22日欧盟CLP法规新增附件VIII(Commission Regulation 2017/542),要求在欧盟境内采用统一的毒物中心通报(PCN),其中就包括在产品的标签上增加UFI信息。同时也规定,如果化学品没有包装或在工厂现场使用,可以在产品的SDS第1.1部分体现UFI信息。
为了执行上述要求,原有的REACH法规附件II也需要修订,以和上述要求保持一致。
4,落实内分泌干扰物供应链传递的要求
2018年12月7日,欧盟委员会发布了“建立一个全面的有关内分泌干扰物的欧盟框架”的文件,其中对如何通过SDS,沿着供应链进行内分泌干扰物的危害信息传递,提出了很多的具体要求。为了落实上述要求,欧盟此处修订了REACH法规附件II。
5,化学安全使用的内在要求
欧盟CLP法规针对部分化学品分配了特定浓度限值(SCL)、M因子和急性毒性估计值。这些信息对于化学品的安全使用非常重要,因此需要在SDS中体现此类信息。
基于上述5个方面的合规要求,欧盟才发布了新版的REACH法规附件II。
二、新文件有哪些新要求?
对照上面介绍的5个方面背景介绍,小编按照SDS十六个部分的顺序,总结了本次修订的主要内容:
1,SDS第1部分

图1 UFI典型示意图
UFI是企业利用ECHA提供的UFI生成器,针对每一个配方混合物所分配的唯一识别号,具体格式要求如下:
① 由16位数字和字母组成;
② 字母必须大写;
③ 每4个数字/字母一组,中间用“-”隔开;
④ 不允许使用易混淆的字母,例如:O,I,L,B和Z;
⑤ 使用时,开头加上“UFI:”。
2,SDS第2部分
在SDS的第2.3部分“其他危害(other hazards)”需要展示的信息中,本次修订增加了物质是否具有内分泌干扰物的说明,具体包括如下两个方面:
①物质是否因为属于内分泌干扰物,而列入REACH法规附件 XIV授权清单中,图2展示了清单中所包括的两种内分泌干扰物。

图2 REACH法规附件XIV中内分泌干扰物示意图
②物质是否符合(EU)2017/2100或(EU)2018/605所确定的内分泌干扰物确定标准。
3,SDS第3部分
第3部分有关物质或混合物组分信息的展示,本次修订此部分新增内容较多,具体分为纯物质和混合物两个部分:
①纯物质
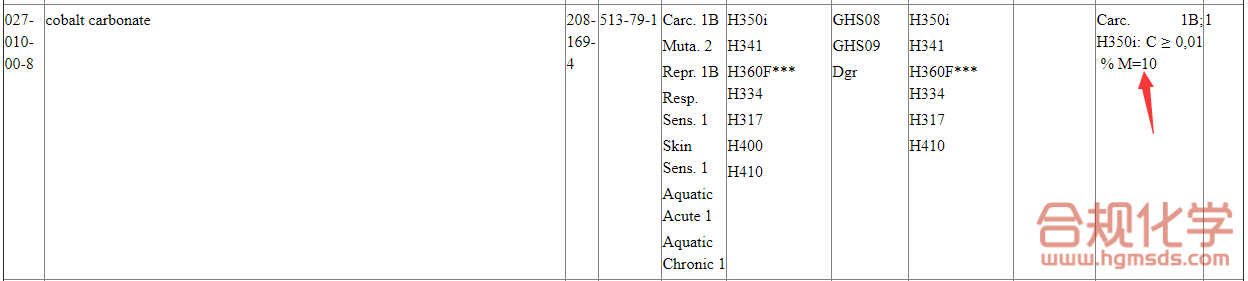
*如果已知物质的SCL(specific concentration limit),M因子和急性毒性估计值,则需要在第3部分予以展示。此类信息可以从欧盟CLP法规附件VI第3部分的统一分类清单中查询到,或者依据CLP法规附件1确定,具体图3和图4所示。
|
|
图3 欧盟CLP法规附件VI“统一分类清单”示意图
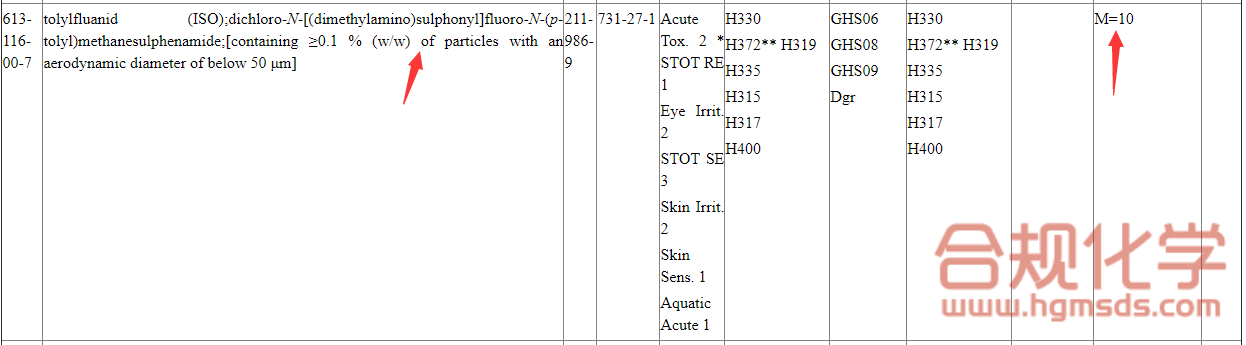
*如果已注册物质涉及纳米尺寸,则相关的纳米粒径应该体现,具体可以参考欧盟CLP法规附件VI,具体如图4所示。
|
|
图4 欧盟CLP法规附件VI有关纳米材料粒径的示意图
*对于未注册的化学物质,如果SDS覆盖了纳米形式,则影响物质安全使用的相关纳米粒径应该在此处体现。
②混合物
在编制混合物SDS时,大家经常会对第3部分混合物中哪些组分需要展示?此次修订新增了以下几种情况:
情况1:混合物整体按照CLP法规分类,具有物理或健康或环境危害
*混合物中具有健康或环境危害的物质,当满足以下条件时,需要展示:
Ø 物质浓度≥CLP法规附件I第3~5部分,健康、环境和附加危害的通用浓度限值(Generic Concentration Limits, GCL)。对于部分危害的GCL值,需要关注特殊规定,例如在主管当局提出要求时,企业有义务提供SDS。
Ø 吸入危害的组分,浓度≥1%;
Ø 皮肤致敏或呼吸致敏的组分,浓度≥特定浓度限值(SCL)的1/10。
Ø 部分危害类别的通用临界值(Generic Cut-off values)(详见CLP法规附件I表1.1)做了修订,具体如表1所示。
表1 通用临界值有变化的危害类别
|
组分危害类别 |
通用临界值(Generic Cut-off values) |
|
|
新的 |
旧的 |
|
|
呼吸致敏 1A类 |
≥0.01% |
≥0.1% |
|
皮肤致敏 1A类 |
≥0.01% |
≥0.1% |
|
呼吸危害 |
≥1% |
≥10% |
*混合物中含有内分泌干扰物【依据(EU)2017/2100或(EU)2018/605】,且浓度≥0.1%。
*依据CLP法规,混合物中具有健康或环境危害的物质,当满足以下条件时,需要展示:
情况2:混合物整体按照CLP法规分类,没有物理或健康或环境危害
满足表2所示的组分也需要在SDS第3部分展示。
表3 所需展示的组分
|
组分危害类别 |
浓度要求 |
组分危害分类依据 |
|
内分泌干扰物 |
≥0.1% |
依据(EU)2017/2100或(EU)2018/605 |
|
皮肤致敏1类,或1B类 |
≥0.1% |
依据CLP法规 |
|
呼吸致敏1类,或1B类 |
≥0.1% |
|
|
致癌物2类 |
≥0.1% |
|
|
皮肤致敏1A类 |
≥0.01% |
|
|
呼吸致敏1A类 |
≥0.01% |
|
|
生殖毒性(所有类别,包括附加危害) |
≥0.1% |
|
|
皮肤致敏或呼吸致敏 |
≥SCL的1/10 |
情况3:纯物质新增的展示要求,同样适用于混合物中的组分
4,SDS第9部分
第9部分是有关化学品理化性质,本次修订直接采纳了联合国GHS第7修订版的技术内容。一方面对展示的理化参数做了修订和增加,具体如下:
①将原来的“外观(Appearance)”修改为”物理状态(physical state)”;
②将原来的“黏度(Viscosity)”修改为“运动黏度(Kinematic viscosity)”
③新增“颜色(Colour)”和“颗粒特征(Particle characteristics)”
此外,本次修订才难了联合国GHS法规(第七修订版)SDS编写指南(附件4)中表A4.3.9.2和表A4.3.9.3有关物理危害相关的数据和其他安全特性内容。
5,SDS第11和第12部分
第11部分展示了产品的健康危害信息,包括GHS分类中急性毒性、皮肤腐蚀/刺激等10项危害的详细信息;而第12部是有关产品的环境危害信息,包括急性慢性水生危害,生物蓄积潜力、土壤迁移能力等。
本次修订在这两部分的“其他危害”中,增加了一条有关“内分泌干扰物信息”的描述。
如果物质属于内分泌干扰物,则在此部分应该详细描述由此产生的具体健康和环境危害信息。
三、小结
本期合规解读,小编详细解读了欧盟REACH法规新发布的附件II有关SDS编写要求。本次修订是欧盟其他法规生效的内在要求,同时也紧跟联合国GHS制度的更新步伐。通过上述解读,大家可以发现新文件对SDS的编写要求集中体现在增加了有关内分泌干扰物、纳米材料、以及SDS第3部分阈值、M值等信息。
友情提醒:新的编写要求给了企业足够长的过渡期,出口欧盟的相关企业也需要关注此项技术变更,提前做好SDS更新!
上一篇:如何编制一份合规的SDS?(下)
下一篇:如何编制一份合规的SDS?(上)

 电话咨询
电话咨询 微信扫码登录
微信扫码登录 账号密码登录
账号密码登录